Diagnostic- Sérologie
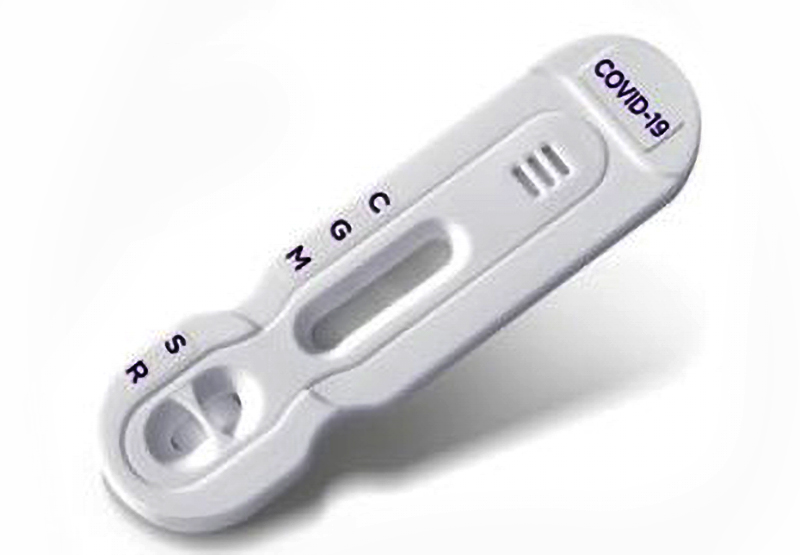
NG-Test® IgG-IgM COVID-19
NG BIOTECH

NG BIOTECH
Pour les données de spécificité, sensibilité et seuil de détection se référer à la fiche technique NG-Test® IgG-IgM COVID-19
Ces dispositifs médicaux de diagnostic in vitro sont des produits de santé
réglementés qui portent le marquage CE. A destination des professionnels de santé.
Lire attentivement les instructions figurants sur les notices d’utilisation.
CODE NABM : 4721 (B35)
Ce test sérologique ultra-rapide développé, fabriqué et validé cliniquement en France par la société NG BIOTECH, permet, en 15 minutes, de détecter et de différencier simultanément l’éventuelle présence des anticorps d’isotypes IgM (immunoglobulines M) et IgG (immunoglobulines G) produits par l’organisme lors de l’infection par le virus SARS CoV-2.
Ces nouveaux dispositifs de diagnostic in vitro viennent étoffer l’offre de tests d’EUROBIO SCIENTIFIC permettant la biologie délocalisée. Sa commercialisation, sous la forme d’un dispositif unitaire ‘ tout-en-un ‘, est dédiée à la surveillance du personnel médical et aux patients potentiellement à risque.
EUROBIO SCIENTIFIC vous propose son test sérologique WANTAI SARS-CoV-2 Ab ELISA permettant la détection des anticorps totaux comme indicateur d’une réponse immunitaire au SARS CoV-2 chez les patients suspectés d’une infection au SARS CoV-2, ou pour la détection de la séroconversion chez les patients suite à une infection récente au SARS CoV-2. Le test peut être utilisé selon les indications :
Évaluations des performances (cliquez sur les liens pour ouvrir chaque rapport d’étude)
Le kit détecte les Anticorps totaux (IgG, IgM et IgA) dirigés contre S1-RBD et il a été largement évalué et validé en Europe. Aux Pays-Bas, le centre médical Erasmus a montré une sensibilité de 98% (100%> 14 jours), la Sanquin Blood Bank a calculé une VPP de 99%, 88% et 72% dans les régions où la prévalence était de 4-10%, 2-4% et <2% et le RIVM National Institute for Public Health rapporte une sensibilité de 97,7% (> 10 jours) ~ 99,5% (> 14 jours). Le Statens Serum Institut au Danemark a montré une sensibilité de 71% (7 ~ 13 jours) ~ 100% (10 jours) et la Medizinische Universität Wien en Autriche, la sensibilité calculée était de 92 à 100%. En France, le Centre National de Référence (CNR) a évalué le kit et conclu qu’il a une sensibilité de 100% (7-13 jours), 95% (14-19 jours) et 98% (> 20 jours) respectivement. Une concordance de plus de 98% avec les immunoessais automatisés a été démontrée au cours d’une étude menée par l’ Hôpital Universitaire de Padoue , en Italie.
Une spécificité très élevée (> 98%) a été montrée dans toutes les études cliniques.



Ces tests s’inscrivent dans la deuxième phase de l’épidémie, où, après les tests de biologie moléculaire pour détecter la présence spécifique du virus, il faut recourir à des tests sérologiques pour identifier la présence d’anticorps contre SARS CoV-2 chez les patients. Dans l’immédiat, ces tests vont permettre de définir précisément la population immunisée contre la maladie. Dans un deuxième temps, ils permettront d’identifier les individus qui nécessiteront une vaccination lorsque celle-ci sera disponible.
Ces coffrets complètent la gamme de plus de 160 paramètres des automates MAGLUMI de SNIBE (Shenzhen New Industries Biomedical Engineering Co, Chine) dont EUROBIO SCIENTIFIC a la distribution exclusive pour la France, l’Angleterre et l’Irlande, ainsi qu’une distribution non-exclusive pour le BENELUX.
Ces équipements, capables de traiter 40 à 280 échantillons par heure avec de 9 à 25 paramètres à bord, sont parfaitement dimensionnés pour le dépistage de masse voulu par les gouvernements des pays européens.
* La technologie en chimiluminescence CLIA utilisée sur les machines MAGLUMI est robuste et très sensible et permet de réaliser toutes sortes de tests, des plus simples jusqu’aux plus complexes.

